lunes, 12 de abril de 2010
Estado Liquido
ESTADO LIQUIDO
Los líquidos, al igual que los sólidos, tienen volumen constante. En los líquidos las partículas están unidas por unas fuerzas de atracción menores que en los sólidos, por esta razón las partículas de un líquido pueden trasladarse con libertad. El número de partículas por unidad de volumen es muy alto, por ello son muy frecuentes las colisiones y fricciones entre ellas.
Así se explica que los líquidos no tengan forma fija y adopten la forma del recipiente que los contiene. También se explican propiedades como la fluidez o la viscosidad.
En los líquidos el movimiento es desordenado, pero existen asociaciones de varias partículas que, como si fueran una, se mueven al unísono. Al aumentar la temperatura aumenta la movilidad de las partículas (su energía).
Características Generales:
Un líquido está formado por moléculas que están en movimiento constante y desordenado, y cada una de ellas choca miles de millones de veces en un lapso muy pequeño. Pero, las intensas fuerzas de atracción entre cada molécula, o enlaces de hidrogeno llamados dipolo-dipolo, eluden el movimiento libre, además de producir una cercanía menor que en la que existe en un gas entre sus moléculas.
Además de esto, los líquidos presentan características que los colocan entre el estado gaseoso completamente caótico y desordenado, y por otra parte al estado sólido de un liquido (congelado) se le llama ordenado. Por lo tanto podemos mencionar los tres estados del agua (liquido universal), sólido, gaseoso y liquido.
De lo cual concluimos a las siguientes características:
- Tienen volumen constante.
- Son incomprensibles.
- Tienen fuerte fricción interna que se conoce con el nombre de viscosidad.
2. Densidad y Peso Específico:
densidad.- la densidad de una muestra se define como la masa de unidad de volumen. La densidad se puede emplear para distinguir entre dos sustancias. Se suele expresarse en g/cm3 o g/ml.
densidad = mas
Volumen
| Sustancia | Densidad en kg/m3 | Densidad en g/c.c. |
| Agua | 1000 | 1 |
| Aceite | 920 | 0,92 |
| Gasolina | 680 | 0,68 |
| Plomo | 11300 | 11,3 |
| Acero | 7800 | 7,8 |
| Mercurio | 13600 | 13,6 |
| Madera | 900 | 0,9 |
| Aire | 1,3 | 0,0013 |
| Butano | 2,6 | 0,026 |
| Dióxido de carbono | 1,8 | 0,018 |
peso Específico (Gravedad Específica).- Es la relación de su densidad a la densidad del agua a una determinada temperatura de referencia.
Peso específico = densidad del líquid
densidad del agua
3. Presion de Vapor:
La presión parcial de las moléculas de vapor por encima de la superficie de un líquido es la presión de vapor, lo cual se debe a los impactos de sus moléculas contra las superficies que confinan al gas y como la superficie del líquido constituye una de las paredes que limitan al vapor, habrá también una serie continua de impactos contra esta superficie por las moléculas en estado gaseoso.
4. Tensión de Vapor:
La presión ejercida por el vapor en tal condición de (aumento o disminución de velocidad de condensación), se llama tensión de vapor del líquido. Todos los materiales, sean líquidos o sólidos, presentan tensiones de vapor definidas, con aalores grandes, pequeños o muy pequeños, cualquiera que sea la temperatura de la sustancia. La magnitud de la tensión de vapor no depende de las cantidades del líquido y del vapor.
El factor más importante que determina la magnitud de la presión de vapor al equilibrio o tensión de vapor del líquido, lo constituye la propia del líquido, la tensión de vapor depende exclusivamente sobre de las fuerzas atractivas entre las moléculas.
5. Humedad:
La humedad atmosférica es la cantidad de vapor de agua existente en el aire. Depende de la temperatura, de forma que resulta mucho más elevada en las masas de aire caliente que en las de aire frío. Se mide mediante un aparato denominado higrómetro, y se expresa mediante los conceptos de humedad absoluta, específica, o relativa del aire.
La humedad absoluta es la masa total de agua existente en el aire por unidad de volumen, y se expresa en gramos por metro cúbico de aire. La humedad atmosférica terrestre presenta grandes fluctuaciones temporales y espaciales.
La humedad específica mide la masa de agua que se encuentra en estado gaseoso en un kilogramo de aire húmedo, y se expresa en gramos por kilogramo de aire.
6. Tensión Superficial:
En un líquido, cada molécula se desplaza siempre bajo influencia de sus moléculas vecinas. Una molécula cerca del centro del líquido, experimenta el efecto de que sus vecinas la atraen casi en la misma magnitud en todas direcciones.
Sin embargo, una molécula en la superficie del líquido no esta completamente rodeado por otras y, como resultado, solo experimenta la atracción de aquellas moléculas que están por abajo y a los lados.
![]()
Donde:
- r = Radio del tubo capilar.
- h = Altura medida desde el nivel del líquido en el tubo de ensaye, hasta el nivel del líquido en el tubo capilar.
- g = Aceleración de la gravedad.
- q = Angulo de contacto en el líquido con las paredes del tubo capilar.
- g = Tensión superficial.
Para los líquidos que mojan el vidrio, su ángulo de contacto se supone a 0°, y sacando el (cos 0°) es 1, por lo que la ecuación anterior se reduce a:
![]()
Donde:
La tensión superficial mide las fuerzas internas (energía) que hay que vencer para expandir el área superficial de un líquido.
Las moléculas en la superficie del líquido están menos atraídas por las fuerzas intermoleculares, por lo que prefieren situarse en el interior (figura 6.1). La tensión superficial mide la energía necesaria para ampliar la superficie de un líquido.
Diferencia entre las fuerzas que actúan sobre una molécula dentro del líquido y las que actúan sobre una molécula en la superficie. Hay una fuerza resultante hacia el interior de la disolución sobre las moléculas de la superficie. Esta fuerza es la responsable de que las gotas de agua sean esféricas, ya que una esfera tiene un área menor que cualquier otra forma del mismo volumen.
7. Viscosidad (Frotamiento Interno):
Algunos líquidos, literalmente fluyen lentamente, mientras que otros fluyen con facilidad, la resistencia a fluir se conoce con el nombre de viscosidad. Si existe una mayor viscosidad, el líquido fluye más lentamente. Los líquidos como la maleza y el aceite de los motores son relativamente viscosos; el agua y los líquidos orgánicos como el tetracloruro de carbno no lo son. La viscosidad es la resistencia de un líquido a fluir y se relaciona con las fuerzas intermoleculares d atracción y con el tamaño y forma de las partículas que o constituyen.
La viscosidad puede medirse tomando en cuenta el tiempo que transcurre cuando cierta cantidad de un líquido fluye a través de un delgado tubo, bajo la fuerza de la gravedad. En otro método, se utilizan esferas de acero que caen a través de un líquido y se mide la velocidad de caída. Las esferas más lentamente en los líquidos más viscosos. Si deseamos determinar la viscosidad con respecto al tiempo, es decir el volumen del líquido que fluye con respecto al tiempo tenemos:
![]() ........................ecuación 1
........................ecuación 1
Donde:
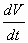 = Velocidad de flujo del líquido a lo largo de un tubo.
= Velocidad de flujo del líquido a lo largo de un tubo. - r = Radio del tubo.
- L = Longitud
- (P1 - P2) = Diferencia de presión
8. Solución:
A.- Características Generales:
- Las soluciones son mezclas homogéneas de dos o más especies moleculares puras y distintas en la cual no se da la precipitación.
Las soluciones incluyen diversas combinaciones en que el sólido, el líquido o el gas actúan como disolvente o soluto, la homogeneidad de sus componentes se considera desde un punto de vista de una escala molecular.
9. Solubilidad:
Otra propiedad física que permite conocer el tipo de enlace es la solubilidad. Los compuestos con enlace iónico son solubles en agua y los que tienen enlace covalente se disuelven en otros compuestos covalentes. Esta propiedad tiene varias excepciones, la fundamental es que las sustancias que tienen moléculas con muchos átomos de oxígeno y que no son macromoléculas son solubles en agua porque los átomos de oxígeno se unen con los átomos de hidrógeno del agua.
Estado Solido


Los sólidos se caracterizan por tener forma y volumen constantes. Esto se debe a que las partículas que los forman están unidas por unas fuerzas de atracción grandes de modo que ocupan posiciones casi fijas.
En el estado sólido las partículas solamente pueden moverse vibrando u oscilando alrededor de posiciones fijas, pero no pueden moverse trasladándose libremente a lo largo del sólido.
Las partículas en el estado sólido propiamente dicho, se disponen de forma ordenada, con una regularidad espacial geométrica, que da lugar a diversas estructuras cristalinas.
Un cuerpo sólido, uno de los cuatro estados de agregación de la materia, se caracteriza porque opone resistencia a cambios de forma y de volumen. Existen varias disciplinas que estudian los sólidos:
La física del estado sólido estudia cómo emergen las propiedades físicas de los sólidos a partir de su estructura de la materia condensada.
- La mecánica de sólidos deformables estudia propiedades macroscópicas desde la perspectiva de la mecánica de medios continuos (tensión, deformación, magnitudes termodinámicas, &c.) e ignora la estructura atómica interna porque para cierto tipo de problemas esta no es relevante.
- La ciencia de los materiales se ocupa principalmente de propiedades de los sólidos como estructura y transformaciones de fase.
- La química del estado sólido se especializa en la síntesis de nuevos materiales.
Manteniendo constante la presión a baja temperatura los cuerpos se presentan en forma sólida y encontrándose entrelazados formando generalmente estructuras cristalinas. Esto confiere al cuerpo la capacidad de soportar fuerzas sin deformación aparente. Son, por tanto, agregados generalmente rígidos, incompresibles (que no pueden ser comprimidos), duros y resistentes. Poseen volumen constante y no se difunden, ya que no pueden desplazarse.
| Los sólidos presentan propiedades específicas:
|
Materia

Todo cuanto nos rodea en la naturaleza está constituido por materia, que es lo que forma los cuerpos. La materia se nos presenta en tres estados físicos, llamados estados de agregación: sólido, líquido y gaseoso, y puede pasar de un estado a otro al variar la temperatura, produciéndose los “cambios de estado”.


